산화 리튬
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
산화 리튬(Li₂O)은 리튬과 산소의 화합물로, 백색 분말 형태의 이온 결정이다. 리튬 금속 연소, 과산화 리튬의 열분해, 수산화 리튬 또는 탄산 리튬의 분해 반응을 통해 생성된다. 산화 칼륨 및 산화 나트륨과 유사한 역형석형 구조를 가지며, 물과 반응하여 수산화 리튬을 생성하고 이산화 탄소를 흡수하여 탄산 리튬을 형성한다. 세라믹 유약의 플럭스, 열 차폐 코팅 시스템의 평가 및 모니터링, 리튬 금속 생산 등에 사용된다.
더 읽어볼만한 페이지
- 리튬 화합물 - 유기리튬 시약
유기리튬 시약은 탄소-리튬 결합을 가진 화합물로 카를 치글러, 게오르크 비티히, 헨리 길먼 등에 의해 개발되었으며 극성을 띠는 결합과 강염기성 및 친핵성을 이용하여 유기 합성 반응에서 친핵체, 탈양성자화제, 중합 개시제 등으로 널리 쓰인다. - 리튬 화합물 - 과산화 리튬
과산화 리튬(Li2O2)은 이산화 탄소를 흡수하고 산소를 방출하는 특징으로 밀폐된 공간의 공기 정화나 리튬-공기 전지의 핵심 구성 요소로 사용되는 무기 화합물이다. - 산화물 - 산화 아연
산화 아연(ZnO)은 흰색 분말 형태의 양쪽성 산화물로, 고무, 안료, 의약품, 세라믹, 전자 장치 등 다양한 산업 분야에 사용되며 높은 굴절률, 열전도율, 항균성 및 자외선 차단 능력을 지닌 물질이다. - 산화물 - 이산화 규소
이산화규소(SiO₂)는 규소 원자와 산소 원자가 사면체 구조로 결합된 3차원 네트워크 고체 화합물로, 결정질과 비결정질의 다양한 형태로 존재하며, 지구 지각에서 풍부하게 발견되고 산업적으로 널리 사용되지만, 미세 결정질 형태는 건강 문제를 일으킬 수 있다.
2. 생산
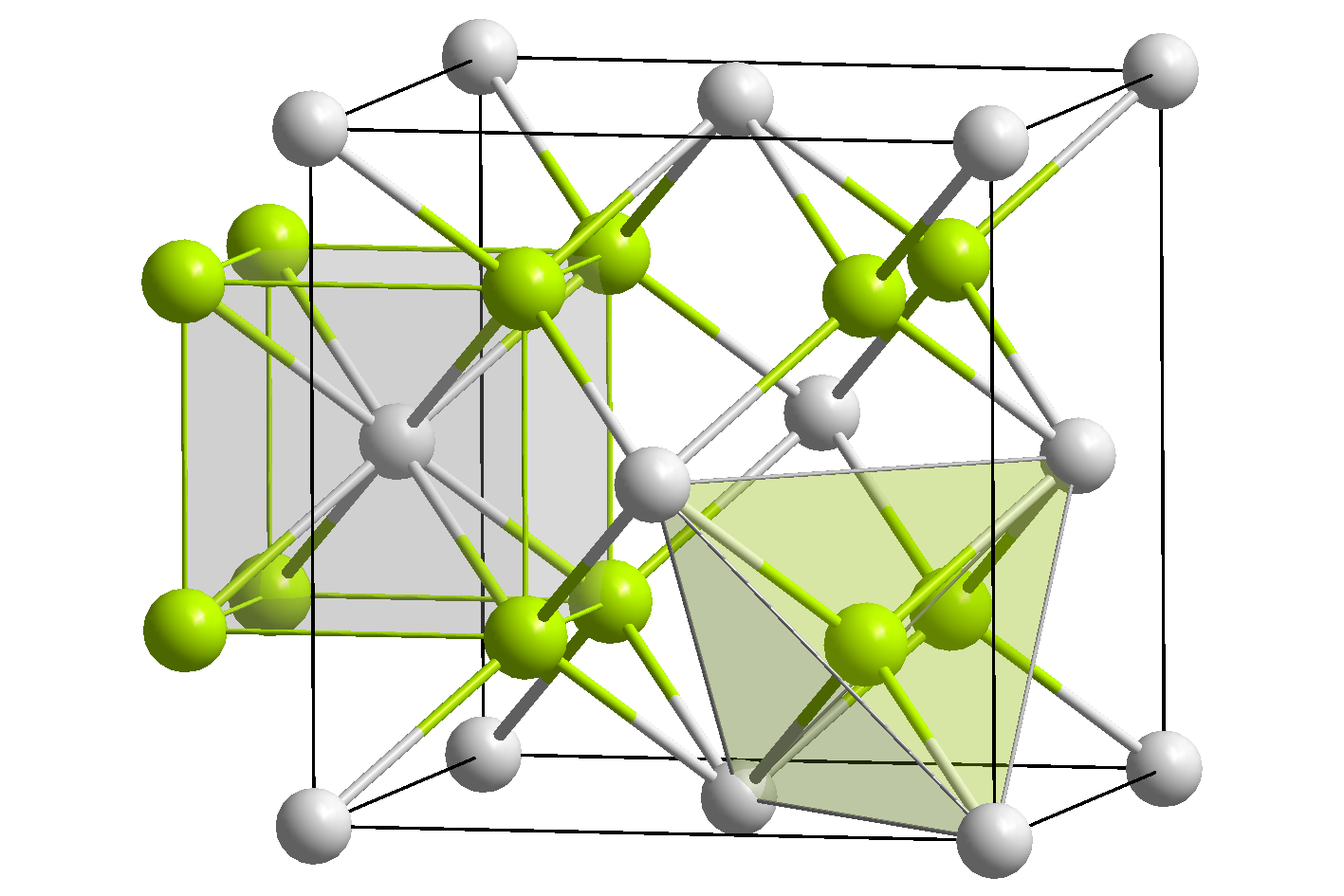
고체 산화 리튬은 반플루오라이트 구조를 가지며, 4배위 Li+ 중심과 8배위 산화물을 갖는다.[4]
이산화 탄소와 반응하면 탄산 리튬을 형성한다.[7]
산화 리튬은 세라믹 유약의 플럭스로 사용되며, 구리와 함께 사용하면 파란색을, 코발트와 함께 사용하면 분홍색을 낸다. 산화 리튬은 물 및 증기와 반응하여 수산화 리튬을 생성하므로, 이들과 격리해야 한다.[1]
[1]
서적
Handbook of Inorganic Chemicals
McGraw-Hill
2002

산화 리튬은 리튬 금속이 공기 중에서 연소되어 100°C 이상의 온도에서 산소와 결합할 때 소량의 과산화 리튬과 함께 형성된다.[2]
: 4Li + O2 → 2Li2O
450°C에서 과산화 리튬(Li2O2)을 열분해하여 순수한 Li2O를 생산할 수 있다.[1][3]
: 2Li2O2 → 2Li2O + O2
금속 리튬을 공기 중 및 산소 중에서 연소시키면 산화 리튬이 생성된다. 다른 알칼리 금속과 달리 산소와의 직접 반응에서는 과산화 리튬(Li2O2) 및 초산화 리튬(LiO2)은 생성되지 않는다.
은 박으로 감싼 무수 수산화 리튬을 니켈 보트 내에서 감압 하에 675℃로 가열 분해하면 산화 리튬을 얻을 수 있다.[8]
: 2LiOH → Li2O + H2O
또한 탄산 리튬을 700℃에서 50시간 감압 하에서 가열하여 분해시켜도 산화 리튬을 얻을 수 있다.
: Li2CO3 → Li2O + CO2
무수 과산화 리튬을 헬륨 중에서 450℃로 6시간 가열하여 분해시켜도 산화 리튬을 얻을 수 있다.
: 2Li2O2 → 2Li2O + O2
3. 구조
바닥 상태의 기체 Li2O 분자는 강한 이온 결합과 일치하는 결합 길이를 갖는 선형 구조를 갖는다.[5][6] VSEPR 이론에서는 H2O와 유사한 굽은 형태를 예측할 것이다.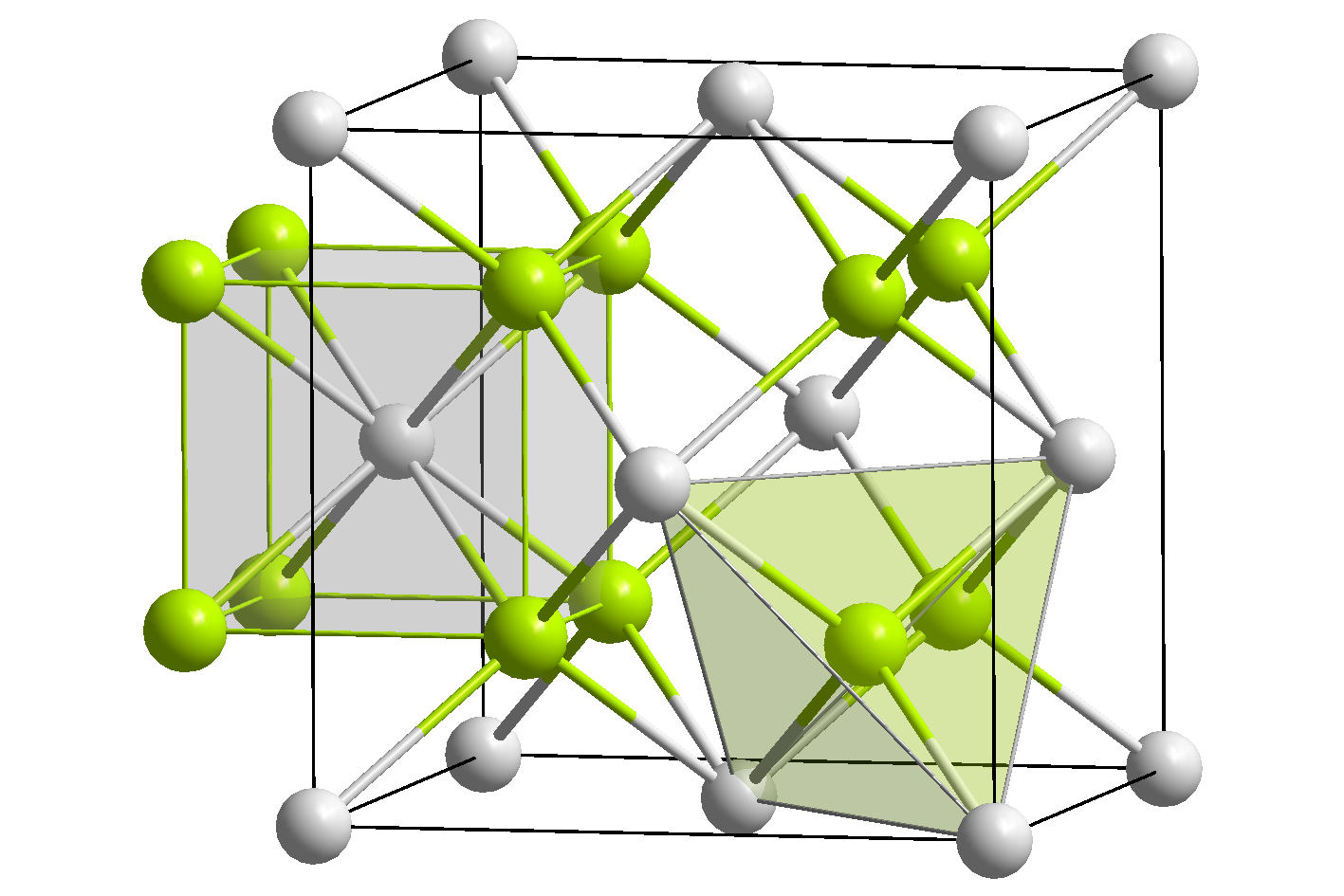
__ O2− __ Li+
산화 리튬은 산화 칼륨 및 산화 나트륨과 마찬가지로 입방정계의 역형석형 구조를 가지며, 리튬 이온(Li+)은 정사면체 4배위, 산화물 이온(O2−)은 입방체 8배위가 된다. 격자 상수는 a = 4.61Å이다.[9]
4. 성질
산화 리튬은 리튬 금속이 공기 중에서 연소되어 100°C 이상의 온도에서 산소와 결합할 때 소량의 과산화 리튬과 함께 형성된다.[2]
:4Li + O2 → 2Li2O.
순수한 Li2O는 450°C에서 과산화 리튬(Li2O2)의 열분해로 생산될 수 있다.[1][3]
:2Li2O2 → 2Li2O + O2
백색 분말이며 리튬 이온(Li+)과 산화물 이온(O2-)으로 구성된 이온 결정이다. 다른 알칼리 금속 산화물보다 열역학적으로 안정하며 융점도 상당히 높다.
물과 반응하여 열을 발생시키며 수산화 리튬을 생성한다.
: Li2O + H2O → 2 LiOH, [7]
: Li2O + H2O → 2 Li+(aq) + 2 OH-(aq), [7]
수증기 및 이산화 탄소를 흡수하기 쉽다.
: Li2O + CO2 → Li2CO3
5. 반응
:
물과 천천히 반응하여 수산화 리튬을 생성한다.[7]
:,
:,
수증기 및 이산화 탄소를 흡수하기 쉽다.
6. 용도
또한, 열 차폐 코팅 시스템 내에서 비파괴 방출 분광법 평가 및 열화 모니터링에 대한 사용도 연구되고 있다. 이트리아와 함께 지르코니아 세라믹 탑 코트에 공동 도펀트로 첨가할 수 있으며, 코팅의 예상 수명 저하가 크지 않다. 고온에서 산화 리튬은 매우 감지 가능한 스펙트럼 패턴을 방출하며, 이는 코팅의 열화와 함께 강도가 증가한다. 이러한 시스템의 현장 모니터링을 구현하면, 고장 또는 필요한 유지 보수까지의 수명을 예측하는 효율적인 수단을 제공할 수 있다.[1]
산화 리튬으로부터 전기 분해를 통해 리튬 금속을 얻을 수 있으며, 부산물로 산소가 방출된다.[1]
참조
[2]
서적
[3]
간행물
Lithium and Lithium Compounds
Wiley-VCH: Weinheim
2005
[4]
논문
Gitterstruktur der Oxyde, Sulfide, Selenide und Telluride des Lithiums, Natriums und Kaliums
1934
[5]
서적
Structural Inorganic Chemistry
Oxford Science Publications
1984
[6]
논문
A spectroscopic determination of the bond length of the LiOLi molecule: Strong ionic bonding
2001
[7]
간행물
The NBS tables of chemical thermodynamics properties
1982
[8]
서적
新実験化学講座 無機化合物の合成I
丸善
1976
[9]
서적
化学大辞典
共立出版
1993
[10]
서적
Handbook of Inorganic Chemicals
McGraw-Hill
2002
[11]
간행물
Lithium and Lithium Compounds
Wiley-VCH: Weinheim
2005
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com